
試験(調査)を依頼される方へ
当院では治験(臨床試験)を実施しております。
治験(臨床試験)は医師が主体となって実施しておりますが、治験管理室では、治験が適切かつ安全に行われるように患者さまや医師のサポートを行っております。
ここでは患者さま、製薬会社、試験(調査)関連企業に向けて、治験などに関する情報を提供しております。
当院では、創薬・育薬へ貢献すべく、質の高い治験を迅速かつ円滑に実施できるよう努めています。試験(調査)のご依頼を希望される方は、まずは試験(調査)実施手続きについてをご覧下さい。
試験(調査)実施手続き
治験(製造販売後臨床試験)を依頼される方へ
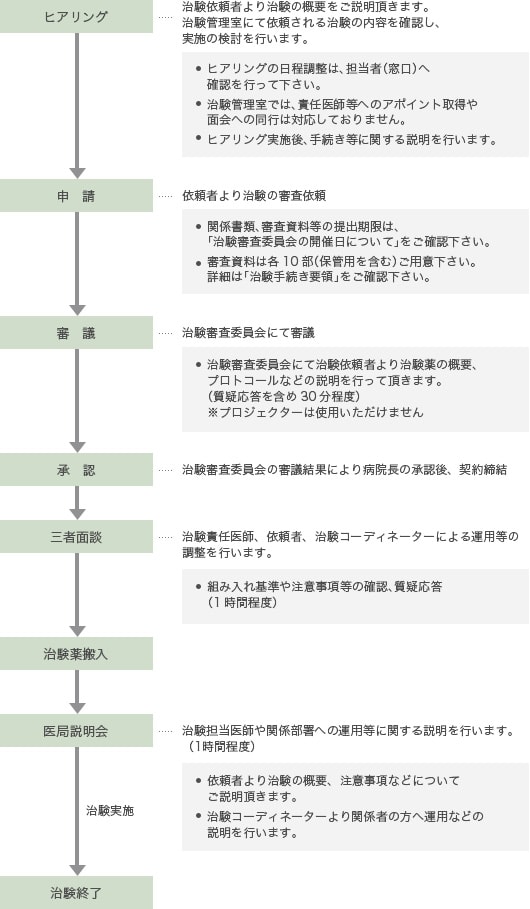
治験実施の手続きについて
各種規定などについて
様式集などについて
- 書式1 履歴書
- 書式2 治験分担医師・治験協力者 リスト
- 書式3 治験依頼書
- 書式4 治験審査依頼書
- 書式5 治験審査結果、指示・決定通知書
- 書式6 治験実施計画書等修正報告書
- 書式8 緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書
- 書式9 緊急の危険を回避するための治験実施計画書からの逸脱に関する通知書
- 書式10 治験に関する変更申請書
- 書式11 治験実施状況報告書
- 書式12 重篤な有害事象に関する報告書(医薬品治験)
- 書式13 重篤な有害事象に関する報告書(医薬品製造販売後臨床試験)
- 書式14 重篤な有害事象及び不具合に関する報告書(医療機器治験)
- 書式15 重篤な有害事象及び不具合に関する報告書(医療機器製造販売後臨床試験)
- 書式16 安全性情報等に関する報告書
- 書式17 治験終了(中止・中断)報告書
- 書式18 開発の中止等に関する報告書
- 書式19 重篤な有害事象及び不具合に関する報告書(再生医療等治験)
- 書式20 重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床治験)
- 詳細記載用 書式12_13_14_15_19_20共通
- 別紙1 治験費用算定見積書(医薬品)
- 別紙2 治験費用算定書(医薬品)
- 別紙3 治験費用算定見積書(医薬機器)
- 別紙4 治験費用算定書(医療機器)
- 別紙5 治験費用算定見積書(再生医療)
- 別紙6 治験費用算定書(再生医療)
- 別紙7 住友病院治験に係わる経費算出基準
- 別表1 治験経費ポイント算出表(医薬品)
- 別表2 治験薬管理ポイント算出表
- 別表3 治験経費ポイント算出表(医療機器)
- 別表5 治験経費ポイント算出表(再生医療等製品)
- 別表6 治験製品管理ポイント算出表
- 参考 院内書式一覧
- 雛形 同意撤回書(住友病院ver)
- 雛形 負担軽減費に関する同意説明文書
- 1-1 治験契約書 二者(治験 医薬品)
- 1-2 治験契約書 二者(治験 医療機器)
- 1-3 治験契約書 二者(治験 再生医療等製品)
- 2-1 治験契約書 三者(治験 医薬品)
- 2-2 治験契約書 三者(治験 医療機器)
- 2-3 治験契約書 三者(治験 再生医療等製品)
- 3 治験契約変更覚書 二者(治験)
- 4 治験契約変更覚書 三者(治験)
- 5-1 製造販売後臨床試験契約書 二者(製販後 医薬品)
- 5-2 製造販売後臨床試験契約書 二者(製販後 医療機器)
- 5-3 製造販売後臨床試験契約書 二者(製販後 再生医療等製品)
- 6-1 製造販売後臨床試験契約書 三者(製販後 医薬品)
- 6-2 製造販売後臨床試験契約書 三者(製販後 医療機器)
- 6-3 製造販売後臨床試験契約書 三者(製販後 再生医療等製品)
- 7 製造販売後臨床試験契約変更覚書 二者(製販後)
- 8 製造販売後臨床試験契約変更覚書 三者(製販後)
- 9 治験に関わる経費に関する覚書(SMO費用一体)
- 10 治験に関わる経費に関する変更覚書
- 11 治験に関する変更報告書
- 12 逸脱に関する報告書(緊急の危険回避を除く)
製造販売後調査を依頼される方へ
調査の手続きについて
調査の手続要領は以下の通りとなります
-
申請
- 事前に「調査を依頼する科の診療主任部長」に調査協力の内諾を得た上で申請してください
- 必要事項を以下のフォームで入力してください
製造販売後調査 申請フォームはこちら - 折り返し治験管理室担当者よりメール送信します
-
申請書類等の提出
- 申請に必要な書類等の提出前に書類入力内容を確認いたしますので、書類に必要事項を入力しメール添付して治験管理室担当者までご送信ください
- 入力内容に問題なければ、書類に必要な押印(調査代表医師、調査依頼者等)を受理し治験管理室宛に書類を郵送してください
- 様式1)製造販売後調査依頼書
- 様式2)製造販売後調査担当者連絡先
- 様式3)製造販売後調査契約書
- 契約書返信用の封筒
書類提出期限;治験審査委員会開催日(定例・毎月第二月曜)の3週前の週末まで
例)治験審査委員会2021年5月10日(月)開催→書類提出期限2021年4月23日(金) - 治験審査委員配布用資料として「製品情報概要,調査実施要項,調査票など」を10セットにして治験管理室宛に郵送してください
-
審議
治験審査委員会当日に事前に郵送頂いてる「製品情報概要,調査実施要項,調査票」などを用いて調査の概略を調査依頼者より説明して頂きます。(説明5分程度、その後質疑応答)
プロジェクターは使用いただけません
説明者用の手元資料はご自身で当日ご持参ください
審議終了後、治験審査委員配布用資料「製品情報概要,調査実施要項,調査票など」10セットはその場で返却致します -
契約
- 治験審査委員会審議後、病院長の承認後に契約締結となります
- 治験審査委員会審議結果および病院長の承認結果は治験管理室担当者より連絡します
- 契約書の交付については治験審査委員会審議終了後の一週間程度を目途に、当院経理担当者から返信用封筒で郵送します
-
実施状況報告
- 当院では単年度清算契約をお願いしております。当該年度の3月末までに受領した調査票の数に応じ、当該翌年度の4月中頃以降に入金をお願いいたします
- 調査担当者は毎年度3月末までに以下の書類に必要事項を入力しメール添付して治験管理室担当者までご送信ください
- 入力内容に問題なければ、書類に必要な押印を受理し治験管理室宛に書類を郵送してください
- 全例調査の調査票回収が一旦終了した調査において「症例登録のみ継続」とする場合、一旦調査終了としますので、当院における調査終了手続を行ってください。ただし症例登録自体は各担当医師が継続実施します。改めて再調査が必要となった場合は、別途協議します。
- 当院経理担当者へ入金予定についてご連絡ください
- 調査費用の振込先等については当院経理担当者へお問い合わせください
- 請求書または領収書が必要な場合は、貴社ひな形にて作成しメール添付して当院経理担当者へ送信してください。また合わせて書類返信用封筒も当院経理担当者へ郵送してください。押印後返信用封筒で郵送します
- 調査期間中に担当交代となった場合は、調査担当者はすみやかに以下の書類に必要事項を入力しメール添付して治験管理室担当者までご送信ください
-
契約変更
- 調査代表医師の変更、契約日の延長等で契約変更が必要な場合は、以下の書類に変更内容を入力しメール添付して治験管理室担当者までご送信ください
- 変更内容について別途覚書も作成してください
- 入力内容に問題なければ、書類に必要な押印を受理し治験管理室宛に書類を郵送してください
- 治験審査委員会審議後、病院長の承認後に契約締結となります
- 社名変更や契約者変更等の軽微な変更に関しては契約書内容読み替え対応とし、覚書再締結は不要です
- 契約書の交付については当院経理担当者へお問い合わせください
-
終了
- 調査終了後、調査担当者は以下の書類に必要事項を入力しメール添付して治験管理室担当者までご送信ください
- 入力内容に問題なければ、書類に必要な押印を受理し治験管理室宛に書類を郵送してください
- 当院経理担当者へ入金予定についてご連絡ください
- 調査費用の振込先等については当院経理担当者へお問い合わせください